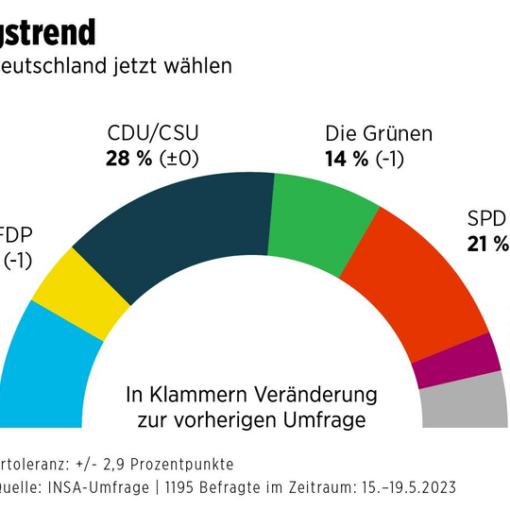
Erstmalig wurde der modRNA-basierte SARS-CoV-2-Impfstoff, bekannt unter den Namen „BNT162b2“, „Tozinameran“, „Pfizer-BioNTech COVID-19 Vaccine“, „Comirnaty“ am 2. Dezember 2020 im Vereinigten Königreich zugelassen. Am 9. Dezember folgte die Zulassung in Kanada, am 11. Dezember die Notfallzulassung in den USA. Am 21. Dezember 2020 erhielt der Impfstoff Comirnaty von BioNTech/Pfizer als erster die bedingte Marktzulassung in der EU.
Die von Pfizer vorgelegten Daten hatten zu der blitzartigen Zulassung seines Covid-Gen-Präparats durch die US-amerikanische Food and Drug Administration (FDA) geführt. Die schnelle Zulassung in den USA war möglich, weil die FDA die rechtliche Möglichkeit nutzte, mittels der Emergency Use Authorization (EUA) eine neue medizinische Behandlung während eines erklärten Notfalls zu genehmigen.
Wiederholt hatte die FDA „volle Transparenz“ in Bezug auf Covid-19-Impfstoffe zugesagt und ihre Verpflichtung zur Transparenz bei der Lizenzvergabe für das Präparat von Pfizer bestätigt. Die FDA hielt ihr Versprechen jedoch nicht ein.